Ջրածինը, (Hydrogenium` լատիներեն ջուր ծնող) պարբերական համակարգի առաջին պարբերության՝ առաջին խմբի, մեկ կարգաթվով տարրն է: Միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11%-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ: Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա լրիվ կազմված է ջրածին քիմիական տարրից: Ցածր ջերմաստիճանի և շատ բարձր ճնշման պատճառով ջրածինն այդ մոլորակի վրա գտնվում է պինդ վիճակում:

Ջրածինը բնության մեջ ազատ վիճակում հանդիպում է չնչին քանակով՝ գլխավորապես մթնոլորտի վերին շերտերում: Երբեմն, այն երկրի ընդերքից դուրս է գալիս այլ գազերի հետ հրաբխային ժայթքումների, ինչպես նաև նավթի արդյունահանման ժամանակ:
Ջրածնի ատոմն ունի ամենապարզ կառուցվածքը` մեկ դրական լիցքով միջուկի շուրջը սփռված է մեկ էլեկտրոն:

Ջրածնի ստացումը.
Ջրածինն ազատ վիճակում առաջին անգամ ստացել է անգլիացի գիտնական Հենրի Քավենդիշը:
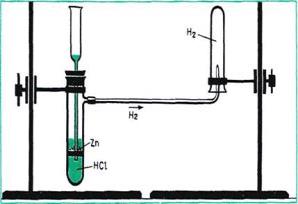
Լաբորատոր պայմաններում ջրածին են ստանում որոշ մետաղների և թթուների (նպատակահարմար է՝ ցինկի ու աղաթթվի) փոխազդեցությունից:
Գոյություն ունեն սարքեր, որոնց միջոցով ջրածին կարելի է ստանալ ընդհատումներով, այսինքն՝ ցանկացած պահի քիմիական ռեակցիան հնարավոր է դադարեցնել և ապա՝ կրկին վերսկսել: Այդպիսի սարքերից են Կիպի ապարատը և ընդհատումներով ջրածին ստանալու փոքր սարքը:

Արդյունաբերության մեջջրածին ստանում են.՝
1. Մեթանի ջերմային քայքայումից
2. Մեթանի և գերտաքացրած ջրային գոլորշիների փոխազդեցությունից
3. Ջրային գոլորշիները բաց են թողնում շիկացած կոքսի (ածուխ, որը շիկացնում են առանց օդի մուտքի) վրայով: Ռեակցիայի հետևանքով ստացված ածխածնի (II) օքսիդը և ջրածնի խառնուրդը անվանում են «ջրագազ»
4. Էլեկտրական հոսանքով ջրի քայքայումից
Ջրածնի ֆիզիկական և քիմիական հատկությունները.
Ջրածինը անհոտ, անգույն, օդից 14,5 անգամ թեթև գազ է: Սովորական պայմաններում ջրածին պարզ նյութը՝ H2, փոխազդում է միայն ֆտորի հետ, իսկ քլորի հետ՝ լույսի ազդեցության տակ: Բազմաթիվ քիմիական տարրերի ատոմների հետ այն փոխազդում է տաքացման պայմաններում: Բարձր ջերմաստիճանում ջրածինն անմիջականորեն փոխազդում է որոշ մետաղների հետ (հիմնականում ալկալիական և հողալկալիական)՝ առաջացնելով մետաղների հիդրիդներ: Օրինակ ՝ նատրիումի հիդրիդ, կալցիումի հիդրիդ: Հիդրիդները սպիտակ, իոնային կապերով, բյուրեղային նյութեր են:


Մետաղների հիդրիդները ջրում հեշտությամբ քայքայվում են՝ առաջացնելով համապատասխան ալկալի և ջրածին: Օրինակ ՝ կալցիումի հիդրիդի և ջրի փոխազդեցությունը: Մետաղների հետ փոխազդելիս ջրածնի ատոմը վերածվում է հիդրիդ իոնի:
Հալոգենների հետ ջրածինն առաջացնում է հալոգենաջրածիններ: Ծծմբի հետ տաքացման պայմաններում առաջանում է ծծմբաջրածին: Ազոտի հետ առաջանում է ամոնիակ միայն կատալիզատորի ներկայացմամբ, բարձր ճնշման և ջերմաստիճանի պայմաններում: Ջրածնի փոխազդեցությունը ոչ մետաղների հետ կարելի է ներկայացնել հետևյալ ընդհանուր ուրվագրով՝ H0 − e− = H+
Ջրածինն օգտագործվում է խիստ արժեքավոր որոշ մետաղների օքսիդներից՝ ազատ վիճակում մետաղ ստանալու համար: Օրինակ՝ վոլֆրամ, վոլֆրամի (III) օքսիդ:

Ջրածնի կիրառումը.
Ջրածինն ունի շատ բարձր ջերմային արժեք և վառվելուց մեծ քանակությամբ էներգիա է անջատում, ըստ այդմ այն շատ լավ վառելիք է։ Ջրածինն օգտագործում են սուզանավերում, տիերզերանավերում և հրթիռներում։ Ըստ գիտնականների, այն ապագայում օգտագործելու են նաև ավտոմեքենաներում։ Ջրածինը բավականին շատ են օգտագործում արդյունաբերության մեջ։ Այն օգտագործվում է նաև սննդի, ներկի, քիմիական և պարարտանյութի արդյունաբերության մեջ, օգտագործում են մաքուր ջուր ստանալու համար։ Ջրածնի դերը բժշկության մեջ շատ կարևոր է։ Բազմաթիվ դեղեր կան, որոնք ջրածին են պարունակում: Ջրածինը կարելի է օգտագործել նաև ատամնաբուժության մեջ։
